普罗维登斯,罗德岛 [布朗大学] — 了解蛋白质的结构对于揭开其功能的神秘面纱和开发靶向它们的药物至关重要。为此,布朗大学的一组研究人员开发了一种使用机器学习来快速预测多种蛋白质构型的方法,以促进对蛋白质动力学和功能的理解。
3月27日星期三,一项描述该方法的研究发表在《自然通讯》上。
作者表示,该技术准确,快速,具有成本效益,并有可能通过发现更多新疗法的靶点来彻底改变药物发现。
例如,在靶向癌症治疗中,治疗旨在将控制癌细胞生长、分裂和扩散的蛋白质归零。结构生物学家面临的挑战之一是充分了解细胞蛋白以识别靶标,该研究的作者Gabriel Monteiro da Silva说,他是布朗大学分子生物学,细胞生物学和生物化学的博士候选人。
蒙泰罗·达席尔瓦(Monteiro da Silva)使用计算方法来模拟蛋白质动力学,并寻找改进方法的方法或找到最适合不同情况的新方法。在这项研究中,他与化学和物理学副教授布伦达·鲁宾斯坦(Brenda Rubenstein)以及其他布朗研究人员合作,试验了一种名为AlphaFold2的现有人工智能计算方法。
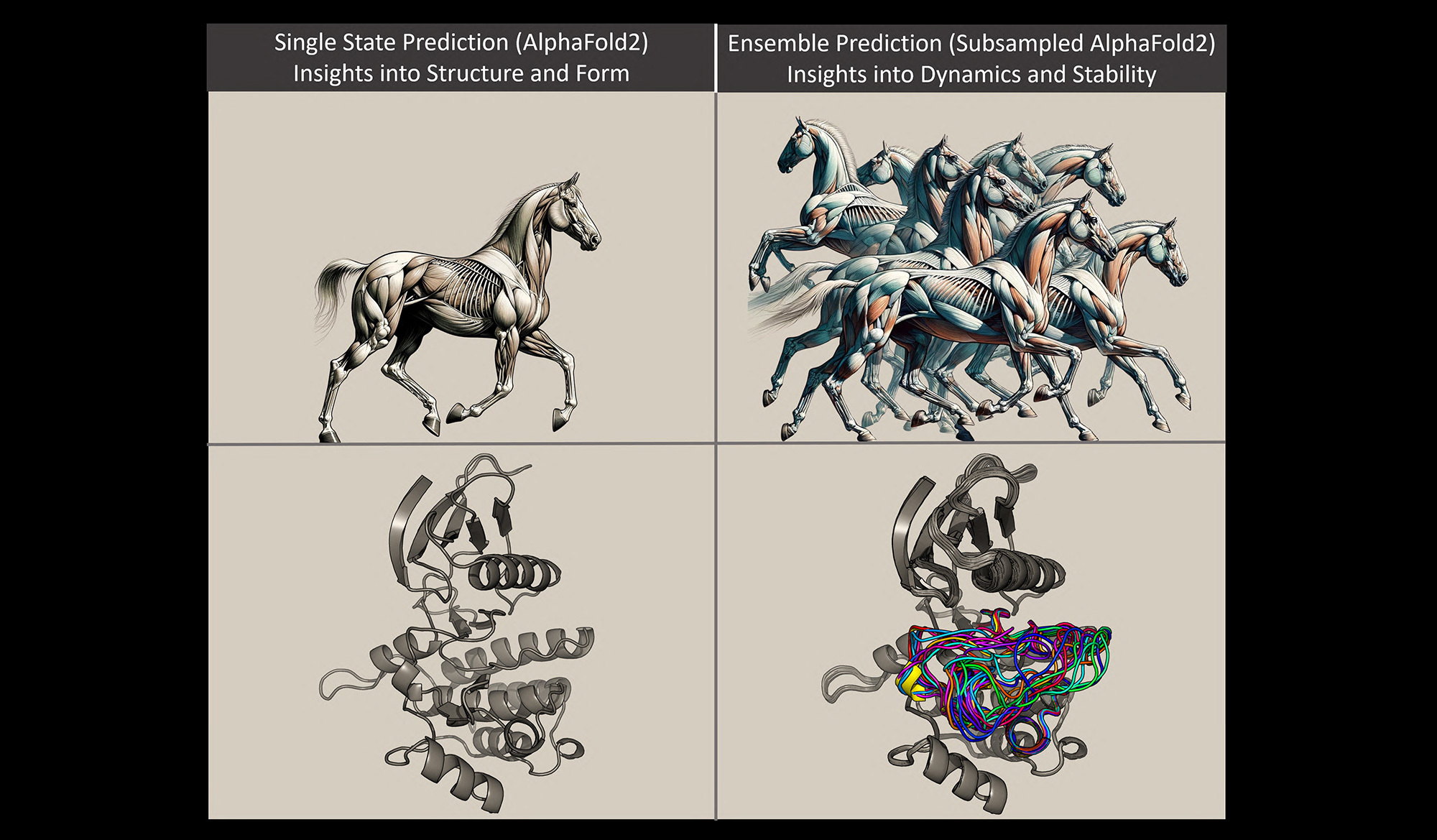
虽然Monteiro da Silva表示,AlphaFold2的准确性彻底改变了蛋白质结构预测,但该方法也有局限性:它允许科学家仅在特定时间点对静态状态的蛋白质进行建模。
“在大多数细胞过程中,蛋白质会动态改变形状,”Monteiro da Silva说。“为了将蛋白质靶点与治疗癌症和其他疾病的药物相匹配,我们需要更准确地了解这些生理变化。我们需要超越 3D 形状来理解 4D 形状,第四个维度是时间。这就是我们用这种方法所做的。
蒙泰罗·达席尔瓦(Monteiro da Silva)用马的比喻来解释蛋白质模型。马的肌肉和四肢的排列根据马是站立还是奔驰而产生不同的形状;蛋白质分子由于其组成原子的键合排列而形成不同的形状。想象一下,蛋白质是一匹马,蒙泰罗·达席尔瓦说。以前的方法用于预测站立的马的模型。这是准确的,但它并没有说明这匹马的行为方式或它不站立时的样子。
在这项研究中,研究人员能够操纵来自蛋白质的进化信号,以使用AlphaFold2快速预测多种蛋白质构象,以及这些结构的填充频率。使用马的类比,新方法允许研究人员快速预测马奔腾的多个快照,这意味着他们可以看到马的肌肉结构在移动时会如何变化,然后比较这些结构差异。
“如果你了解构成蛋白质动态的多个快照,那么你就可以找到多种不同的方法来靶向蛋白质和治疗疾病,”鲁宾斯坦说,他的研究重点是电子结构和生物物理学。
鲁宾斯坦解释说,该团队在这项研究中关注的蛋白质是一种为其开发了不同药物的蛋白质。然而,她说,多年来,没有人能理解为什么有些药物成功或失败。
“这一切都归结为这样一个事实,即这些特定的蛋白质具有多种构象,以及了解药物如何与不同的构象结合,而不是这些技术先前预测的一种静态结构;了解这组构象对于了解这些药物在体内的实际作用非常重要,“鲁宾斯坦说。
加快发现时间
研究人员指出,现有的计算方法既费时又费时。
“它们在材料和基础设施方面都很昂贵;它们需要花费大量时间,而且你不能真正以高吞吐量的方式进行这些计算——我敢肯定,我是 Brown 计算机集群中 GPU 的顶级用户之一,“Monteiro da Silva 说。“在更大的范围内,这是一个问题,因为在蛋白质世界中有很多东西需要探索:蛋白质动力学和结构如何参与知之甚少的疾病,耐药性和新兴病原体。
研究人员描述了蒙泰罗·达席尔瓦(Monteiro da Silva)之前如何花了三年时间使用物理学来了解蛋白质动力学和构象。使用他们新的人工智能方法,发现时间缩短到仅数小时。
“所以你可以想象这会对一个人的生活产生多大的影响:三年与三个小时,”鲁宾斯坦说。这就是为什么我们开发的方法必须高通量和高效,这一点非常重要。
至于下一步,研究团队正在改进他们的机器学习方法,使其更加准确和通用,并且对一系列应用更有用。
这项研究得到了布拉瓦特尼克家庭基金会的支持,该基金会资助了布朗大学的生物学和医学研究生奖学金。2023 年秋季,八名 Blavatnik 家族研究员根据杰出的学术成就被选中,并展示了开展研究以推进基础和临床生命科学知识和理解的潜力。蒙泰罗·达席尔瓦(Monteiro da Silva)是首届研究员之一,合著者詹妮弗·崔(Jennifer Cui)也是其中之一,她正在与分子生物学,细胞生物学和生物化学教授乔治·利西(George Lisi)一起分析参与炎症和细胞信号传导的蛋白质的结构和功能。
普罗维登斯,罗德岛 [布朗大学] — 了解蛋白质的结构对于揭开其功能的神秘面纱和开发靶向它们的药物至关重要。为此,布朗大学的一组研究人员开发了一种使用机器学习来快速预测多种蛋白质构型的方法,以促进对蛋白质动力学和功能的理解。
3月27日星期三,一项描述该方法的研究发表在《自然通讯》上。
作者表示,该技术准确,快速,具有成本效益,并有可能通过发现更多新疗法的靶点来彻底改变药物发现。
例如,在靶向癌症治疗中,治疗旨在将控制癌细胞生长、分裂和扩散的蛋白质归零。结构生物学家面临的挑战之一是充分了解细胞蛋白以识别靶标,该研究的作者Gabriel Monteiro da Silva说,他是布朗大学分子生物学,细胞生物学和生物化学的博士候选人。
蒙泰罗·达席尔瓦(Monteiro da Silva)使用计算方法来模拟蛋白质动力学,并寻找改进方法的方法或找到最适合不同情况的新方法。在这项研究中,他与化学和物理学副教授布伦达·鲁宾斯坦(Brenda Rubenstein)以及其他布朗研究人员合作,试验了一种名为AlphaFold2的现有人工智能计算方法。
虽然Monteiro da Silva表示,AlphaFold2的准确性彻底改变了蛋白质结构预测,但该方法也有局限性:它允许科学家仅在特定时间点对静态状态的蛋白质进行建模。
“在大多数细胞过程中,蛋白质会动态改变形状,”Monteiro da Silva说。“为了将蛋白质靶点与治疗癌症和其他疾病的药物相匹配,我们需要更准确地了解这些生理变化。我们需要超越 3D 形状来理解 4D 形状,第四个维度是时间。这就是我们用这种方法所做的。
蒙泰罗·达席尔瓦(Monteiro da Silva)用马的比喻来解释蛋白质模型。马的肌肉和四肢的排列根据马是站立还是奔驰而产生不同的形状;蛋白质分子由于其组成原子的键合排列而形成不同的形状。想象一下,蛋白质是一匹马,蒙泰罗·达席尔瓦说。以前的方法用于预测站立的马的模型。这是准确的,但它并没有说明这匹马的行为方式或它不站立时的样子。
在这项研究中,研究人员能够操纵来自蛋白质的进化信号,以使用AlphaFold2快速预测多种蛋白质构象,以及这些结构的填充频率。使用马的类比,新方法允许研究人员快速预测马奔腾的多个快照,这意味着他们可以看到马的肌肉结构在移动时会如何变化,然后比较这些结构差异。

“如果你了解构成蛋白质动态的多个快照,那么你就可以找到多种不同的方法来靶向蛋白质和治疗疾病,”鲁宾斯坦说,他的研究重点是电子结构和生物物理学。
鲁宾斯坦解释说,该团队在这项研究中关注的蛋白质是一种为其开发了不同药物的蛋白质。然而,她说,多年来,没有人能理解为什么有些药物成功或失败。
“这一切都归结为这样一个事实,即这些特定的蛋白质具有多种构象,以及了解药物如何与不同的构象结合,而不是这些技术先前预测的一种静态结构;了解这组构象对于了解这些药物在体内的实际作用非常重要,“鲁宾斯坦说。
加快发现时间
研究人员指出,现有的计算方法既费时又费时。
“它们在材料和基础设施方面都很昂贵;它们需要花费大量时间,而且你不能真正以高吞吐量的方式进行这些计算——我敢肯定,我是 Brown 计算机集群中 GPU 的顶级用户之一,“Monteiro da Silva 说。“在更大的范围内,这是一个问题,因为在蛋白质世界中有很多东西需要探索:蛋白质动力学和结构如何参与知之甚少的疾病,耐药性和新兴病原体。
研究人员描述了蒙泰罗·达席尔瓦(Monteiro da Silva)之前如何花了三年时间使用物理学来了解蛋白质动力学和构象。使用他们新的人工智能方法,发现时间缩短到仅数小时。
“所以你可以想象这会对一个人的生活产生多大的影响:三年与三个小时,”鲁宾斯坦说。这就是为什么我们开发的方法必须高通量和高效,这一点非常重要。
至于下一步,研究团队正在改进他们的机器学习方法,使其更加准确和通用,并且对一系列应用更有用。
这项研究得到了布拉瓦特尼克家庭基金会的支持,该基金会资助了布朗大学的生物学和医学研究生奖学金。2023 年秋季,八名 Blavatnik 家族研究员根据杰出的学术成就被选中,并展示了开展研究以推进基础和临床生命科学知识和理解的潜力。蒙泰罗·达席尔瓦(Monteiro da Silva)是首届研究员之一,合著者詹妮弗·崔(Jennifer Cui)也是其中之一,她正在与分子生物学,细胞生物学和生物化学教授乔治·利西(George Lisi)一起分析参与炎症和细胞信号传导的蛋白质的结构和功能。
新闻旨在传播有益信息,英文版原文来自https://www.brown.edu/news/2024-03-27/protein-models