COVID-19病毒进入宿主所需的基本因素之一是人类细胞上的受体——在这个地方,公认的刺突蛋白可以附着在细胞表面,刺穿它,吐出其感染性内容物,并进行复制。
没有受体,就没有复制。没有复制,就没有感染。
普林斯顿大学化学系和分子生物学系的研究人员使用了一种叫做“细胞图谱”的细胞图谱技术,该技术是两年前由麦克米伦实验室引入的,发现了刺突蛋白的8个之前未知的入口点。
研究人员发现,其中四种基因对病毒进入具有重要功能。
这项研究发表在本月早些时候的《美国化学学会杂志》(JACS)上。它可以扩大用于对抗这种病毒的工具套件,特别是在这种病毒变异并进化出逃避疫苗的方法的情况下。

Ploss实验室博士后、JACS论文的第一作者Saori Suzuki;以及分子生物学教授亚历山大·普洛斯。
该合作项目于两年前在大流行的不确定性最严重的时候开始,由著名病毒学家和分子生物学教授Alexander Ploss和诺贝尔化学奖得主James S. McDonnell大学特约教授David MacMillan领导。
自从2003年SARS-CoV-1病毒出现以来,科学家们就知道,它的主要病毒进入受体是一种被称为血管紧张素转化酶2 (ACE2)的酶。这种酶在2020年被证实是导致COVID-19的SARS-CoV-2病毒的相同受体。
但普林斯顿的项目一开始就假设ACE2不是唯一的故事。
普罗斯说:“我们确实知道,这种病毒完全依赖某些宿主分子进入肺细胞引起感染,其中一种分子被称为ACE2。”“所以我们基本上说,好吧,让我们看看是否有更多的。我们寻找即时粘合剂。
“但你可以想象,进入的过程是复杂的。病毒附着在某物上然后它必须穿过细胞膜进入细胞,在这个过程中它可能会与其他宿主因子相互作用。我不想说一切都是由病毒进入决定的。显然,在病毒进入细胞后,细胞内有许多同样重要的过程可以影响疾病的严重程度。

Steve Knutson,化学博士后研究员
“但这显然是关键的第一步。如果病毒无法进入,游戏就结束了。”
该论文的合著者、麦克米伦实验室的博士后研究员史蒂夫·克努森补充说:“虽然ACE2作为主要受体的发现是一个巨大的里程碑,但它当然不能说明COVID病理的全部故事。生物学本质上可能是混杂的,我们猜测正确,SARS-CoV-2刺突蛋白与多个宿主细胞蛋白质相互作用进入。”
他补充说,像这样的调查是一个“完美”的研究,适合于µMap技术。
针尖为微磁图天线
微图谱(micromap)是一种接近标记技术,可以识别细胞表面的蛋白质和酶“邻居”。它使用光催化剂——一种分子,当被光激活时,会引发化学反应——通过产生标记分子邻居的标记来标记这些空间关系。
在这项工作中,研究人员使用刺突蛋白本身作为标记物或“天线”来标记ACE2附近的所有受体位点。
麦克米伦说:“亚历克斯有一种伟大的直觉,认为除了ACE2外,还有其他东西可以让你思考传染性。”“所以我们所做的是把这种光催化剂——我们称之为天线——放在刺突蛋白上,这样当它与ACE2附近细胞上的东西结合时,这个小天线就会吸收光子能量和光。
“但它不能把能量传递到很远的地方。它只能把它给附近的人。自由漂浮的分子基本上必须在两纳米范围内遇到它,”麦克米伦补充说。“所以我们知道它旁边是什么。我们知道与它相互作用的是什么。”
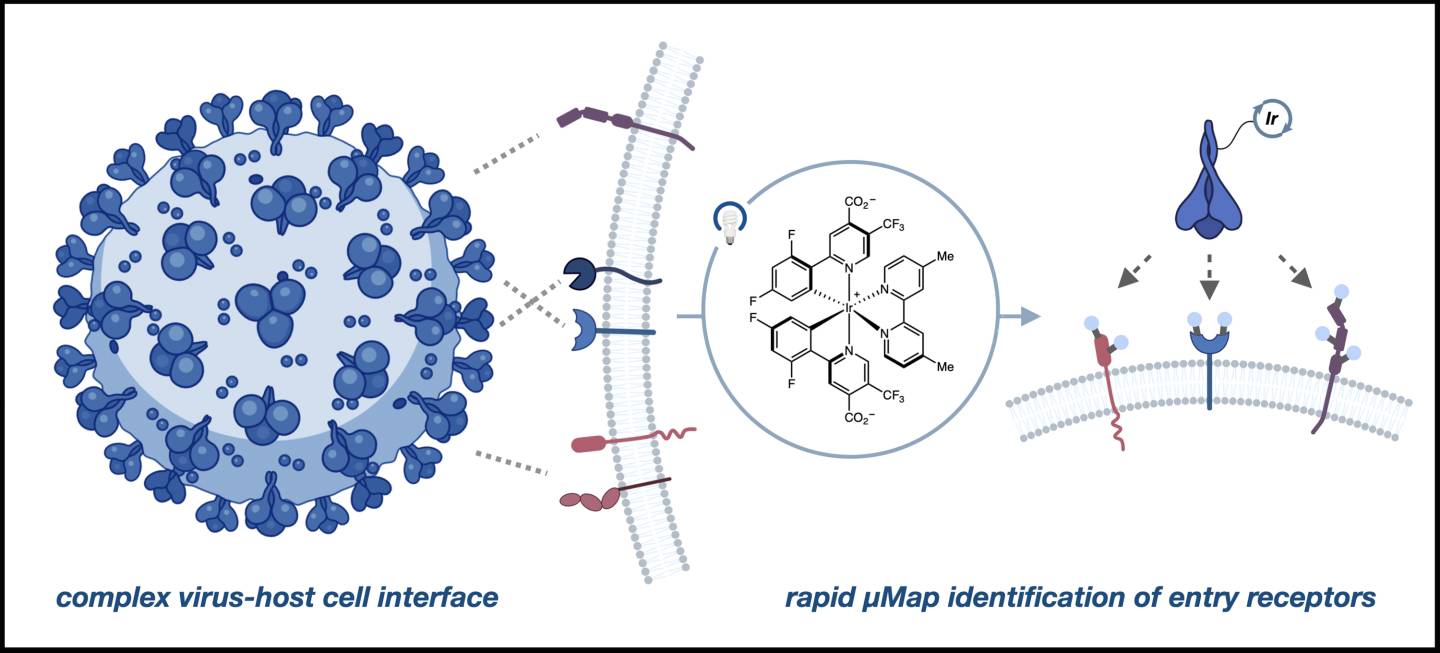
宿主细胞和病毒的界面可以是复杂的,涉及许多蛋白质,但µMap可以直接询问功能上重要的相互作用。
在该技术确定了8种与刺突蛋白相互作用的新受体后,科学家们使用病毒伪粒子对它们进行了表征。(假粒子模拟病毒进入,但不携带传播病毒的遗传物质。)然后,他们分离出了四个值得进一步研究的入口因素。
普洛斯说:“伪粒子系统使我们能够将病毒吸收分离出来,并研究感染周期下游所有东西的进入过程。”“如果你在寻找某些宿主因素对进入的影响,你希望看到你可以独立于复制研究它。所以在这里,我们基本上是在向细胞中引入一个报告基因,然后可以量化进入的效率。”
麦克米伦说,要最终确定受体的功能还需要进一步的研究,但研究人员想知道它们是否可能是疾病严重程度的线索。
普洛斯实验室的副研究学者铃木Saori说:“我们不能说所有8个因素都与SARS-CoV-2的进入有关。”“通过病毒学评估,8个因素中有4个非常突出。我们需要进行更多、更精确的评估。
“下一步,我们需要评估这些因素如何支持病毒进入ACE2,以及新出现的病毒变体是否利用同一组因素。”
Saori Suzuki, Jacob B. Geri, Steve D. Knutson, Harris Bell-Temin, Tomokazu Tamura, David F. Fernández, Gabrielle H. Lovett, Nicholas A. Till, Brigitte L. Heller, Jinchao Guo, David W. C. MacMillan和Alexander Ploss发表在9月1日的《美国化学学会杂志》(DOI: 10.1021/jacs.2c06806)上。该研究的部分资金来自美国国立卫生研究院(R01AI138797, R01AI107301, R01AI146917和R01AI153236,授予A.P.和UL1TR003017的一部分),Burroughs Wellcome基金发病机制研究者奖(101539授予A.P.),普林斯顿COVID-19研究基金通过研究主任办公室,以及NIH国家普通医学科学研究所(R35-GM134897-02)。
文章旨在传播新闻信息,原文请查看https://www.princeton.edu/news/2022/09/21/more-possible-entry-points-covid-spike-protein-identified-princeton-scientists