大约10%的婴儿天生就有先天性心脏缺陷,其中最常见的是持续性动脉干——心脏上的一个洞。在一个健康的婴儿体内,缺氧的血液通过一条单向血管泵入肺部,在那里它变成含氧的,然后通过一条相邻的血管泵入心脏,就像两个方向的高速公路交通被中间线干净地隔开一样。但是对于患有持续性动脉干的婴儿,这两个通道中间有一个孔,导致含氧和脱氧的血液混合。因此,进入身体的氧气太少,心脏不得不更加努力地工作。手术是必要的,以修复这个洞,和婴儿经常有身体上的困难,在整个童年。
当心脏在发育过程中不能正常形成时,就会产生这个洞,但直到婴儿出生后才能检测到。现在,加州理工学院的一组研究人员以鸡胚胎为模型生物,发现了某些干细胞用来正确形成心脏组织的遗传途径。研究人员说,用这些遗传指令对其他干细胞进行重新编程,将诱导它们制造心脏组织,即使这不是它们最初的目的。
了解这些遗传过程有一天可能使医生能够在婴儿出生前检测出持续的动脉干,并可能在婴儿还在子宫内时不通过手术纠正缺陷。
这项研究是由生物学教授、贝克曼研究所所长玛丽安·布朗纳的实验室进行的,并在5月4日的《发育细胞》杂志上发表了一篇论文。
由于人类胚胎的使用问题,研究人类的发展可能会很困难。布朗纳实验室使用的是鸡胚,它们的发育过程和基因与人类在胚胎早期阶段的情况类似。
在大约两天的发育过程中,一个鸡胚胎已经发育出了一排未分化的干细胞,称为神经嵴细胞,从头部延伸到尾部。这个发育阶段类似于一个月大的人类胚胎。神经嵴细胞是布朗纳实验室的一个重要研究重点,因为它们最终会迁移到整个成形的身体,帮助形成面部骨骼和心脏的部分,以及其他东西。
虽然神经嵴细胞都是同一类型的细胞,但它们的工作却因它们在迁移前的发源地不同而不同。例如,来自颈部的神经嵴细胞,或心脏神经嵴细胞,可以继续形成心肌,而来自背部的神经嵴细胞,即躯干神经嵴细胞,则不能。如果心脏的神经嵴细胞被破坏,胚胎就不能正常形成心脏,导致诸如动脉干持续存在等缺陷。从头部或背部移植的神经嵴细胞无法修复这种情况。
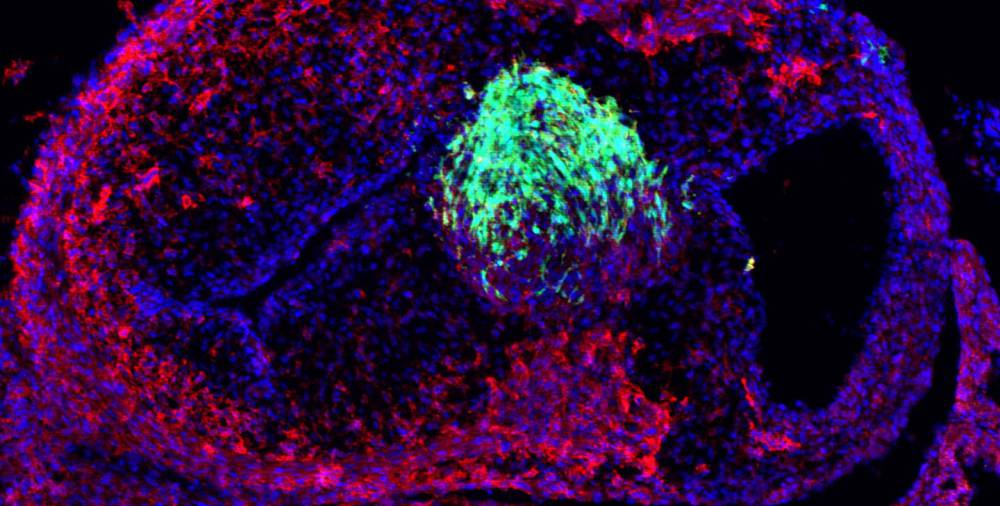
在这项新的研究中,研究生Shashank Gandhi发现了使心脏神经嵴细胞有别于其他类型神经嵴细胞的基因和遗传途径。甘地与洛约拉·玛丽蒙特大学的马克斯·埃辛合作,在鸡胚胎中实验剔除了这些基因,发现心肌没有正常形成。
更重要的是,甘地通过表达这个心脏神经嵴基因回路,在遗传上重新编码了这个主干神经嵴细胞。甘地说,"重编程类似于在Mac电脑上安装Windows操作系统。"我们预测这组基因可能会覆盖这些细胞的原始程序,从而改变它们的功能。为了验证这个想法,甘地和埃辛将这些重新编程的细胞移植到颈部。值得注意的是,这些细胞迁移到心脏并发育成心脏组织,其行为类似于心脏神经嵴细胞。
布朗纳说:“我们对这些结果感到非常兴奋,因为这是首次表明少量的基因能够使神经嵴细胞形成屏障,将流入和流出心脏和肺的血液分隔开来。”我们希望这能使人们对引起心脏异常的先天缺陷有更好的了解
这篇论文的题目是"Reprogramming axial level identity来拯救与神经嵴相关的先天性心脏缺陷。沙尚克·甘地是这篇论文的第一作者。除了Bronner之外,Ezin也是作者之一。美国国立卫生研究院(National Institutes of Health)和美国心脏协会(American Heart Association)提供了资助。Marianne Bronner是加州理工学院天桥和Chrissy Chen神经科学研究所的附属教员。
新闻旨在传播有益信息,英文原版地址:https://www.caltech.edu/about/news/understanding-congenital-heart-defects-one-chicken-time