细胞依靠由蛋白质组装体组成的复杂分子机器来执行能量产生、基因表达和蛋白质合成等基本功能。为了更好地了解这些机器是如何工作的,科学家们通过从细胞中分离蛋白质并使用各种方法来确定它们的结构来捕捉它们的快照。然而,从细胞中分离蛋白质也会将它们从其天然环境中移除,包括蛋白质相互作用伙伴和细胞位置。
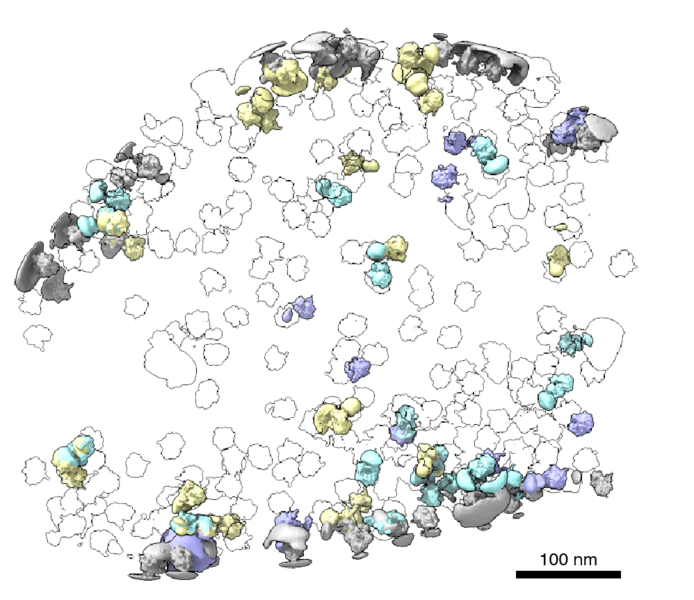
最近,低温电子断层扫描(cryo-ET)已成为一种通过对不同角度的冷冻细胞进行成像以获得三维结构信息来观察蛋白质在其天然环境中的方法。这种方法令人兴奋,因为它允许研究人员直接观察蛋白质如何以及在哪里相互结合,揭示细胞内这些相互作用的细胞邻域。
麻省理工学院(MIT)的研究生巴雷特·鲍威尔(Barrett Powell)利用了在天然环境中对蛋白质进行成像的技术,他想知道他是否可以更进一步:如果可以观察到分子机器的运行情况会怎样?在3月8日发表在 《自然方法》(Nature Methods)杂志上的一篇论文中,鲍威尔描述了他开发的方法,称为tomoDRGN,用于模拟冷冻电子断层扫描数据中蛋白质的结构差异,这些蛋白质是由蛋白质运动或与不同相互作用伙伴结合的蛋白质引起的。这些变化被称为结构异质性。
尽管鲍威尔以实验科学家的身份加入了麻省理工学院生物学副教授乔伊·戴维斯(Joey Davis)的实验室,但他认识到计算方法在理解细胞内结构异质性方面的潜在影响。此前,戴维斯实验室开发了一种名为cryoDRGN的相关方法,用于了解纯化样品中的结构异质性。当 Powell 和 Davis 看到冷冻电子断层扫描在该领域日益突出时,Powell 接受了重新构想这个框架以在细胞中工作的挑战。
当用纯化的样品求解结构时,每个颗粒只成像一次。相比之下,冷冻电子断层扫描数据是通过从不同角度对每个颗粒进行 40 多次成像来收集的。这意味着 tomoDRGN 需要能够合并来自 40 多张图像的信息,这就是项目遇到障碍的地方:数据量导致信息过载。
为了解决这个问题,Powell 成功地重建了 cryoDRGN 模型,以仅优先考虑最高质量的数据。当对同一粒子进行多次成像时,会发生辐射损伤。因此,较早采集的图像往往质量更高,因为颗粒的损坏较小。
“通过排除一些低质量的数据,结果实际上比使用所有数据要好 – 并且计算性能要快得多,”鲍威尔说。
就在鲍威尔开始测试他的模型时,他运气好:一项开创性的新研究的作者首次以接近原子的分辨率可视化了细胞内的核糖体,并在电子显微镜公共图像档案(EMPIAR)上分享了他们的原始数据。该数据集是 Powell 的一个典型测试案例,通过该数据集,他证明了 tomoDRGN 可以揭示冷冻 ET 数据中的结构异质性。
根据Powell的说法,一个令人兴奋的结果是tomoDRGN在EMPIAR数据集中发现的核糖体子集。一些核糖体颗粒与细菌细胞膜结合,并参与称为共翻译易位的过程。当蛋白质同时合成并跨膜运输时,就会发生这种情况。研究人员可以利用这一结果来提出新的假设,即核糖体如何与其他蛋白质机制一起发挥作用,这些蛋白质机制是将蛋白质运输到细胞外不可或缺的一部分,现在由其天然环境中的复合物结构指导。
在看到 tomoDRGN 可以从结构多样化的数据集中解析结构异质性后,Powell 很好奇:tomoDRGN 可以识别多小的种群?在那次测试中,他选择了一种名为apoferritin的蛋白质,这是一种常用的冷冻电子断层扫描基准,通常被视为结构均匀的。铁蛋白是一种用于铁储存的蛋白质,当它缺乏铁时被称为铁铁蛋白。
令人惊讶的是,除了预期的颗粒外,tomoDRGN还揭示了一小部分铁蛋白颗粒 – 铁结合 – 仅占数据集的2%,这是以前没有报道的。这一结果进一步证明了 tomoDRGN 能够识别很少发生的结构状态,以至于它们可以从 3D 重建中取平均值。
Powell和Davis实验室的其他成员很高兴看到tomoDRGN如何应用于进一步的核糖体研究和其他系统。戴维斯致力于了解细胞如何组装、调节和降解分子机器,因此接下来的步骤包括使用这种新工具更详细地探索细胞内的核糖体生物发生。
“在净化过程中,我们可能失去哪些可能的状态?”Davis问道。“也许更令人兴奋的是,我们可以看看它们如何在细胞内定位,以及它们可能与哪些伴侣和蛋白质复合物相互作用。
新闻旨在传播有益信息,英文版原文来自https://news.mit.edu/2024/exploring-cellular-neighborhood-0311