一些 Covid-19 疫苗安全有效地使用脂质纳米颗粒 (LNP) 将信使 RNA 递送至细胞。麻省理工学院的一项新研究表明,不同的纳米颗粒可用于潜在的阿尔茨海默病(AD)治疗。在多个小鼠模型和培养的人类细胞的测试中,一种新定制的LNP制剂有效地将小干扰RNA(siRNA)递送至大脑的小胶质细胞免疫细胞,以抑制与阿尔茨海默病过度炎症相关的蛋白质的表达。
在之前的一项研究中,研究人员表明,阻断PU.1蛋白活性的后果有助于减少阿尔茨海默病相关的神经炎症和病理学。发表在《先进材料》(Advanced Materials )杂志上的新的开放获取结果通过直接抑制编码PU.1的Spi1基因的表达来减少炎症。更一般地说,这项新研究还展示了一种将RNA递送至小胶质细胞的新方法,到目前为止,这种小胶质细胞很难靶向。
该研究的共同资深作者、麻省理工学院皮考尔神经科学教授、皮考尔学习与记忆与衰老大脑研究所所长Li-Huei Tsai说,她假设LNPs可以作为将siRNA带入小胶质细胞的一种方式,因为清除大脑中废物的细胞具有很强的吸收脂质分子的倾向。她与大卫·科赫研究所教授罗伯特·兰格(Robert Langer)讨论了这个问题,后者因其在纳米颗粒药物递送方面的有影响力的工作而广为人知。他们决定测试用 LNP 递送的 siRNA 降低 PU.1 表达的想法。
“我还记得有一天,我要求与鲍勃会面,讨论测试LNP作为靶向炎症性小胶质细胞的有效载荷的想法,”大脑与认知科学系教员Tsai说。“我非常感谢JPB基金会,他们在没有任何初步证据的情况下支持这个想法。
兰格实验室的研究生杰森·安德烈森(Jason Andresen)和前蔡实验室博士后威廉·拉尔维纽斯(William Ralvenius)领导了这项工作,并且是该研究的共同主要作者。欧文·芬顿(Owen Fenton)是前兰格实验室的博士后,现在是北卡罗来纳大学埃塞尔曼药学院的助理教授,与蔡和兰格一起是共同通讯作者。兰格是化学工程系和生物工程系以及科赫综合癌症研究所的教授。
完善粒子
测试siRNA是否可以治疗性抑制PU.1表达的最简单方法是使用已经可用的递送装置,但该研究的第一个发现是,八种市售试剂中没有一个可以在实验室中安全有效地转染培养的人类小胶质细胞样细胞。
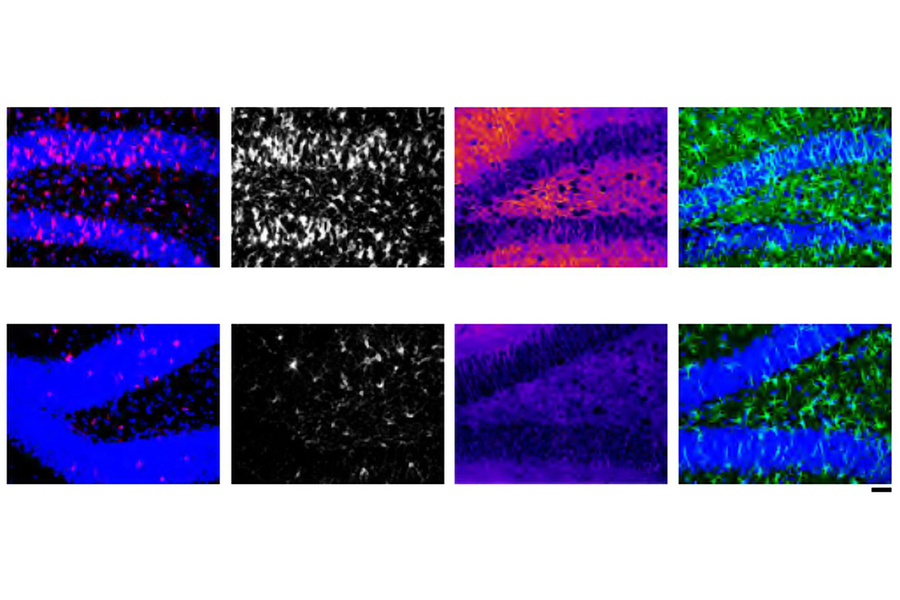
相反,该团队必须优化 LNP 才能完成这项工作。LNP有四个主要组成部分;通过改变其中两种的结构,以及改变脂质与RNA的比例,研究人员能够提出七种配方进行尝试。重要的是,他们的测试包括在他们诱导进入炎症状态的培养小胶质细胞上尝试他们的配方。毕竟,这种状态是需要拟议治疗的状态。
在七个候选者中,一个名为“MG-LNP”的团队因其特别高的交付效率和测试RNA货物的安全性而脱颖而出。
在培养皿中起作用的东西有时在活的生物体中不起作用,因此该团队接下来测试了他们的LNP配方在小鼠中的有效性和安全性。他们测试了两种不同的注射方法,即注射到体内或脑脊液(CSF)中,发现注射到脑脊液中可以确保在不影响其他器官细胞的情况下靶向小胶质细胞的更大功效。在七种制剂中,MG-LNP再次被证明是转染小胶质细胞最有效的。兰格说,他相信有朝一日,这可能会开辟用纳米粒子治疗某些脑部疾病的新方法。
靶向治疗
一旦他们知道MG-LNP可以向人类细胞培养物和小鼠中的小胶质细胞递送测试货物,科学家们就测试了使用它来递送PU.1抑制siRNA是否可以减少小胶质细胞的炎症。在细胞培养物中,相对较低的剂量使PU.1表达降低了42%(这很好,因为小胶质细胞至少需要一些PU.1才能存活)。事实上,MG-LNP转染并未对细胞造成任何伤害。它还显着降低了PU.1在小胶质细胞中表达增加的基因的转录,表明它可以减少多种炎症标志物。
在所有这些措施以及其他措施中,MG-LNP的表现优于科学家并行测试的名为RNAiMAX的市售试剂。
“这些发现支持使用MG-LNP介导的抗PU.1 siRNA递送作为神经炎症性疾病的潜在疗法,”研究人员写道。
最后一组测试评估了MG-LNP在两种小鼠大脑炎症模型中递送siRNA的性能。在一项研究中,小鼠暴露于LPS,LPS是一种模拟感染并刺激全身炎症反应的分子。在另一个模型中,当一种称为CDK5的酶被一种称为p25的蛋白质过度激活时,小鼠表现出严重的神经退行性变和炎症。
在这两种模型中,注射携带抗PU.1 siRNA的MG-LNP会降低PU.1和炎症标志物的表达,这与培养的人类细胞非常相似。
“抗PU.1 siRNA的MG-LNP递送可以潜在地用作全身炎症小鼠的抗炎治疗药物,在AD样神经炎症的CK-p25小鼠模型中,”科学家们总结道,称这一结果为“原理证明”。在人类患者身上尝试这个想法之前,还需要更多的测试。
除了 Andresen、Ralvenius、Langer、Tsai 和 Owen 之外,该论文的其他作者还有 Margaret Huston、Jay Penney 和 Julia Maeve Bonner。
除了JPB基金会和皮考尔学习与记忆研究所外,罗伯特和蕾妮·贝尔弗家族,爱德华多·尤内基安,莱斯特·金佩尔森,杰伊·L.和卡罗尔·米勒,科赫研究所,瑞士国家科学基金会和阿尔茨海默氏症协会为这项研究提供了资金。
新闻旨在传播有益信息,英文版原文来自https://news.mit.edu/2023/nanoparticle-delivered-rna-reduces-neuroinflammation-lab-tests-1215