结肠直肠癌(CRC)是全球癌症死亡的主要原因,只有约 10%的患者在确诊后能存活五年。由宾夕法尼亚大学领导的研究小组在《肠道》(Gut)杂志上发表的一项新研究中发现了晚期 CRC 的潜在治疗靶点。当他们在 CRC 动物模型中抑制 NOTUM 酶时,它能有效阻止肿瘤生长,防止癌症转移。然而,同样的治疗方法对治疗早期癌症无效,因为NOTUM只有在癌症进展时才会成为癌基因–一种癌症生长和扩散所需的因子。
“共同第一作者、兽医学院的李宁(音译)说:”肿瘤行为无法简单分类,因为肿瘤细胞会有效利用基因来确保它们的生存和生长,有时甚至无视作为致癌基因或抑制基因的传统特征。
80%以上的 CRC 病例涉及一种名为 APC 的肿瘤抑制因子的突变。在健康细胞中,APC通过抑制WNT通路来控制肠道上皮细胞的分裂速度。当APC发生突变时,就会抑制WNT,导致细胞分裂失控–这是癌症的特征之一。
然而,APC 并不是 WNT 通路的唯一抑制剂;还有一些细胞外反馈机制也有助于控制 WNT 通路。其中之一就是NOTUM,一种细胞分泌到细胞外空间的酶。李和共同第一作者、宾夕法尼亚兽医学院的克里斯-伦纳(Chris Lengner)希望研究NOTUM在结直肠癌进展中的作用,因为与细胞内或非酶分子相比,NOTUM的细胞外位置和酶活性使它成为一个有吸引力的药物靶点。
为此,研究人员在实验室中培育了人类和小鼠的细胞器。他们利用CRISPR技术引入了与不同阶段的CRC相关的突变,因为随着癌症的发展,癌细胞会积累成熟的突变。然后,他们测试了开启和关闭NOTUM对正常细胞、早期、中期和晚期癌细胞的影响。
研究人员发现,在正常细胞和仅缺少功能性 APC 的早期腺瘤中,NOTUM 可抑制细胞分裂,从而抑制肿瘤生长。然而,随着癌症的发展,APC 和另一种肿瘤抑制因子 P53 都失活了,研究人员惊讶地发现,NOTUM 从抑制因子变成了致癌基因。鉴于APC和P53是结肠癌中最常见的两种突变基因,而且许多晚期患者同时携带这两种突变基因,因此这一点非常重要。
“Lengner说:”有一种基因转换,如果细胞同时失去APC和P53,NOTUM就会从抑癌基因变成癌基因。”功能完全发生了180°的转变”。
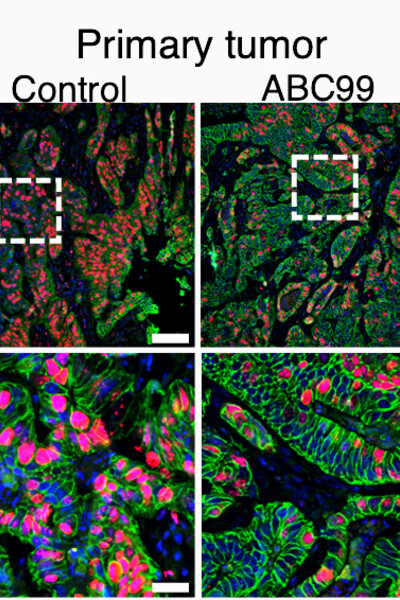
研究小组用不同的方法重新测试了NOTUM,结果证明了这一点,而且他们还发现,这种模式在癌症基因组图谱的人类患者数据中也有所反映。当研究人员在小鼠的 CRC 模型中抑制 NOTUM 时,它有效地减缓了肿瘤的生长,防止了转移,并延长了动物的生存期。
研究人员利用基因技术确定,NOTUM 行为的这种转变是由它与细胞表面称为糖蛋白的蛋白质-碳水化合物复合物的相互作用发生变化引起的,但还需要更多的研究来阐明这一机制。
不过,对人类患者来说,抑制NOTUM可能不是一种临床可行的治疗策略,因为尽管抑制NOTUM可能有助于控制侵袭性晚期肿瘤,但它可能会助长同一患者体内只携带APC突变的其他癌细胞的进展。研究人员认为,糖蛋白可能是选择性抑制这一通路的更有效靶点,这也是他们计划下一步努力的重点。
研究人员说,这些发现还可能让人们了解许多临床癌症试验失败的原因。临床前癌症模型通常只关注疾病的定义版本或基因型,因此在这种狭隘的背景下非常成功的治疗方法,可能会在第一或第二阶段临床试验中对更多样化的患者群体(具有各种突变)进行测试时失败。
“个性化医疗的概念在这里显得尤为重要,”Lengner 说。”如果你只关注那些患有你所知道的在临床前领域有效的疾病或基因突变的患者,那么这可能是一种更有效的试验方式”。
这项研究还表明,可能需要谨慎对待NOTUM抑制的另一种潜在应用:有人(在小鼠体内)探索过用NOTUM抑制剂来使衰老的上皮细胞恢复活力,但如果这样做会增加癌症风险,那就不是一个好主意了。
“伦格纳说:”如果你给APC完全正常的老化肠道注射NOTUM抑制剂,那么是的,它将有助于恢复干细胞活性,但如果肠道中的细胞失去了APC,它可能会加速肿瘤发生。”一旦到了一定年龄,APC丧失基本上是不可避免的–想想结肠镜检查中发现的结肠息肉,这些通常是APC无效病变,因此需要谨慎。
克里斯托弗-伦格纳(Christopher Lengner)是宾夕法尼亚大学兽医学院生物医学科学系哈丽特-埃里森-伍德沃德(Harriet Ellison Woodward)教授兼系主任。
李宁是宾夕法尼亚大学兽医学院的研究助理教授。
该论文的其他作者包括:王欣、Zvi Cramer、Joshua Rhoades、Katrina N. Estep、Stephanie Adams。Estep、Stephanie Adams-Tzivelekidis、Bryson W. Katona、F Brad Johnson、M. Andres Blanco 和宾夕法尼亚大学的田玉华,费城儿童医院的马向辉,以及郑州大学的余正权。
这项研究的经费来自美国国立癌症研究所(R01CA168654和R50CA22184号基金)以及宾夕法尼亚大学再生医学研究所的资助。
新闻旨在传播有益信息,英文版原文来自https://penntoday.upenn.edu/news/genetic-switch-turns-tumor-suppressor-oncogene-colorectal-cancer