尽管药物开发人员在用减少淀粉样蛋白β蛋白的药物治疗阿尔茨海默病方面取得了一些进展,但该疾病的其他问题,包括炎症,仍然没有得到控制。在一项新的研究中,麻省理工学院Picower学习与记忆研究所的科学家描述了一种候选药物,该药物在人类细胞培养和阿尔茨海默氏症小鼠模型中减少了炎症并改善了记忆力。
新的“A11”分子的靶标是一种称为PU.1的遗传转录因子。先前的研究表明,在阿尔茨海默病中,PU.1成为大脑小胶质细胞免疫细胞中炎症基因表达的过度热心主任。新的研究表明,A11通过招募抑制PU.1表达的炎症基因的其他蛋白质来抑制这种有问题的PU.1活性。但由于A11主要集中在大脑中,不会降低PU.1水平,因此它似乎不会破坏PU.1的其他工作,即确保各种血细胞的产生。
“炎症是阿尔茨海默病病理学的主要组成部分,特别难以治疗,”研究资深作者Li-Huei Tsai说,他是麻省理工学院Picower神经科学教授,Picower研究所和麻省理工学院衰老大脑计划主任。“这项临床前研究表明,A11可减少人类小胶质细胞样细胞以及阿尔茨海默病的多种小鼠模型中的炎症,并显着改善小鼠的认知能力。因此,我们认为A11值得进一步开发和测试。
美国国立卫生研究院的Tsai和Elizabeta Gjoneska是8月29日发表在《实验医学杂志》上的这项研究的共同通讯作者。
作为一名博士后,Gjoneska共同领导了一项2015年的研究,该研究涉及PU.1是阿尔茨海默病小鼠模型中错误小胶质细胞炎症的调节剂。这项研究是蔡的实验室与麻省理工学院计算机科学教授Manolis Kellis之间的合作,由前博士后Andreas Pfenning共同领导,他现在是卡内基梅隆大学的教员。从那时起,蔡一直在寻求一种安全的方法,将PU.1活性恢复到更健康的水平。
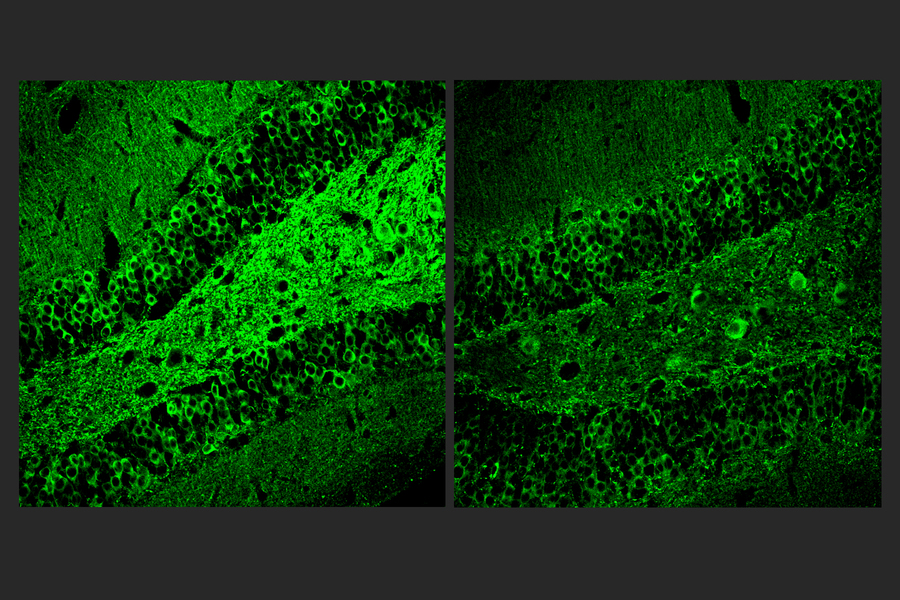
由皮考尔研究所研究科学家William Ralvenius领导的新论文中描述的工作从实验开始,以进一步验证PU.1将是一个具有治疗意义的靶标。为此,科学家们比较了来自阿尔茨海默氏症患者和小鼠模型的死后大脑样本免疫细胞中的基因表达,并与非阿尔茨海默氏症对照相匹配。比较表明,阿尔茨海默氏症影响小胶质细胞基因表达的重大变化,PU.1与炎症基因靶标结合的增加是该变化的重要组成部分。此外,他们表明,在阿尔茨海默氏症小鼠模型中降低PU.1活性可以减少炎症和神经变性,即神经元的死亡。
筛选成功
基因敲低体内的PU.1不是一种可行的治疗策略,因为它在正常健康功能中很重要。因此,该团队从FDA批准的药物和新型化学品库中筛选了超过58,000个小分子,看看是否有任何小分子可以安全显着地减少细胞培养物中PU.1调节的关键炎症和阿尔茨海默氏症相关基因。经过几轮越来越严格的筛选,他们将范围缩小到六种化学物质。A11是迄今为止其中最强大的。
他们测试了A11剂量对从患者干细胞培养的人小胶质细胞样细胞功能的影响。当他们将小胶质细胞样细胞暴露于通常引发炎症的免疫分子时,给予A11的细胞表现出炎症细胞因子的表达和分泌减少,以及与小胶质细胞炎症反应相关的细胞体型变化较少。细胞也显示出较少的脂质分子积累,这是炎症激活的另一个迹象。通过观察基因表达模式,科学家们观察到暴露于炎症触发因素的A11处理细胞的行为与未受干扰的小胶质细胞非常相似,这表明A11有助于防止小胶质细胞对炎症线索反应过度。
另外两项旨在了解A11如何发挥其作用的实验室测试表明,它不会改变PU.1水平。相反,它通过招募几种蛋白质来抵消PU.1活性,包括MECP2,HDAC1,SIN3A和DMNT3A,已知这些蛋白质会抑制其靶标的表达。从本质上讲,在阿尔茨海默病中,A11抑制了PU.1的放大。
“A11代表了一种一流的分子,它将PU.1从转录激活剂转化为转录抑制因子,导致小胶质细胞炎症的受控状态,”作者写道。
迷宫中的老鼠
在确定A11降低小胶质细胞的炎症活性并确定其如何发生后,研究小组专注于它是否在阿尔茨海默病小鼠模型中作为药物起作用。
药理学测试表明,A11很容易从组织中清除,并且能够到达脑细胞。此外,在健康小鼠中,这种化学物质成功地穿过血脑屏障,并在脑细胞中停留的时间比其他任何地方都要长得多。
最后,研究小组测试了药物对三种小鼠品系的阿尔茨海默病病理和症状的影响,每种小鼠品系都模拟阿尔茨海默病的不同方面:CK-p25小鼠(严重神经变性),Tau P301S转基因小鼠(tauopathy)和5XFAD小鼠(淀粉样蛋白病理学)。
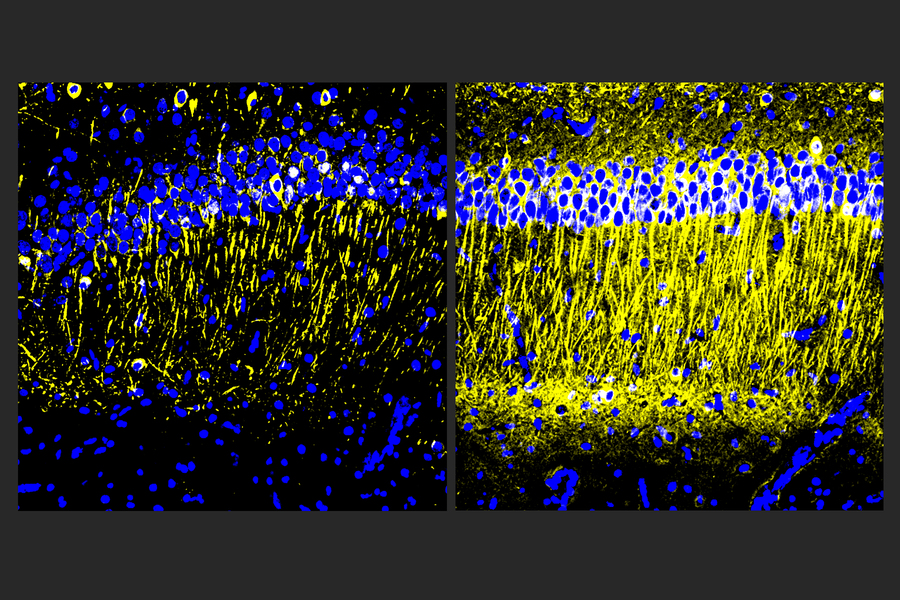
与未治疗的对照相比,给予A11的雄性和雌性CK-p25小鼠在小胶质细胞和星形胶质细胞中表现出较少的炎症反应,并且失去的神经元更少。TauP301S Tg小鼠的反应类似,也表现出大脑海马区磷酸化tau蛋白的显着减少,这是记忆的重要区域。在5XFAD小鼠中,淀粉样蛋白显着减少。
上一项
研究小组将Tau P301S Tg和CK-p25小鼠置于迷宫中,旨在测试它们的短期工作记忆和长期学习。在两个模型和两个测试中,A11处理的小鼠比未处理的对照组表现明显更好。例如,在“莫里斯水迷宫”中,小鼠必须学习允许它们休息的水下平台的位置,经过治疗的CK-p25小鼠比未经治疗的小鼠学习得更快。
Tsai说,在A11成为批准的药物之前,还需要做更多的测试,但她指出,它可以补充针对淀粉样蛋白的新疗法。
“鉴于A11通过与现有AD [阿尔茨海默病]疗法不同的机制起作用,A11可以单独使用或与批准的疗法结合使用,为神经退行性疾病提供更好的治疗选择,”作者总结道。
除了Tsai,Gjoneska和Ralvenius之外,该论文的其他作者还有Alison E. Mungenast,Hannah Woolf,Margaret M. Huston,Tyler Z. Gillingham,Stephen K. Godin,Jay Penney,Hugh P. Cam,Fan Gao,Celia G. Fernandez,Barbara Czako,Yaima Lightfoot,William J. Ray,Adrian Beckmann,Alison M. Goate,Edoardo Marcora,Carmen Romero-Molina,Pinar Ayata和Anne Schaefer。
Robert A.和Renee E. Belfer家庭基金会以及美国国立卫生研究院资助了这项研究。其他支持来自JPB基金会和Picower学习与记忆研究所,哈利斯家庭基金会,Lester A. Gimpelson和Jay L.以及Caroll Miller。
新闻旨在传播有益信息,英文版原文来自https://news.mit.edu/2023/molecule-reduces-inflammation-alzheimers-models-0905