
蛋白质是生命的主力军。生物体将它们用作构建块、受体、处理器、信使和催化剂。蛋白质的结构对其功能至关重要。畸形的蛋白质不仅无法执行其任务,而且会积累并最终粘合细胞的内部运作。因此,错误折叠的蛋白质会导致各种退行性疾病,从阿尔茨海默氏症和帕金森氏症到致盲性疾病视网膜色素变性。这些疾病目前无法治愈。
加州大学圣塔芭芭拉分校的一篇论文揭示了一种特定的离子传输蛋白与细胞垃圾处理之间的新联系,该垃圾处理会研磨错误折叠的蛋白质以避免其毒性积累。该研究结果发表在《发育细胞》(Developmental Cell)杂志上,确定了治疗这些衰弱疾病的靶点。
“通过研究果蝇卵巢中的基础细胞生物学,我们偶然发现了一种预防神经退行性变的方法,我们认为这在治疗某些人类疾病方面具有潜在的应用,”资深作者Denise Montell说,他是分子,细胞和发育生物学系的Duggan教授和杰出教授。
35年来,蒙特尔的实验室一直在研究果蝇卵巢中细胞的运动。她是第一个承认,这可能看起来很深奥,但它为细胞迁移提供了一个奇妙的模型。“细胞运动是胚胎发育的基础,推动伤口愈合并促进肿瘤转移,”她解释说。“因此,这是一个非常基本的细胞行为,我们想要深入了解。
背景和角色
这篇论文的主角是一个叫做 ZIP7的基因,它编码一种同名的蛋白质。在之前的研究中,蒙特尔的团队发现了该基因的突变,该突变损害了细胞的流动性,这引起了他们的兴趣。
ZIP7 蛋白在细胞内运送锌离子。这些离子在细胞质中极为罕见,但在蛋白质中含量丰富,它们通常构成结构的一部分并催化化学反应。“ZIP7在从植物到酵母再到苍蝇再到人类的进化中是保守的,”蒙特尔说。“所以它正在做一些非常基本的事情,因为它已经存在了很长时间。
ZIP7也是在内质网中发现的唯一锌转运蛋白,内质网是一种膜结构,细胞在其中制造蛋白质,用于细胞外膜或细胞分泌物。我们大约三分之一的蛋白质都是在这里制造的。
如果ZIP7是我们的主角,那么错误折叠的蛋白质及其处置就是研究的主题。对于蛋白质来说,功能遵循形式。仅仅拥有正确的成分是不够的,蛋白质必须正确折叠才能正常发挥作用。错误折叠的蛋白质是导致许多疾病和紊乱的原因。
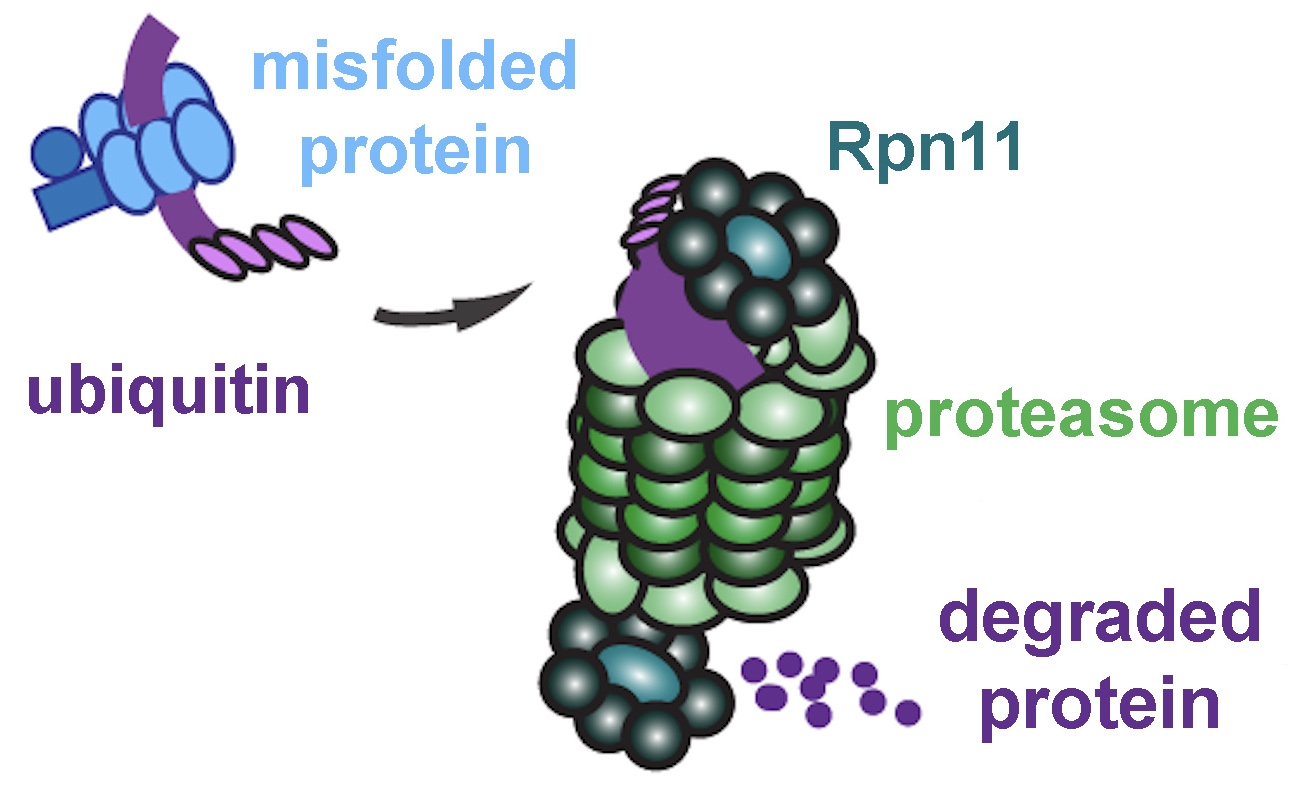
但即使在健康的细胞中,蛋白质有时也会错误折叠。幸运的是,细胞有一个质量控制系统来应对这种可能性。如果误差很小,单元格可以再次尝试折叠它。否则,它会用一种叫做泛素的小蛋白质标记错误折叠的分子,并将其送出内质网(ER)进行回收。
在细胞质中等待的是称为蛋白酶体的结构,即细胞的“垃圾处理”。“它实际上将蛋白质咀嚼成小块,然后可以回收利用,”蒙特尔说。
“但是,如果垃圾处理不堪重负 – 有人在那里放了太多的土豆皮 – 那么细胞就会经历ER压力。这会触发一种反应,减慢蛋白质合成速度(暂停我们的马铃薯准备工作)并产生更多的蛋白酶体,以便系统可以清除积压的废物。如果所有这些都失败了,细胞就会经历程序性死亡。
剧情变厚了
共同主要作者、Montell的前博士生Xiaoran Guo发现,ZIP7的缺失导致了果蝇卵巢的ER应激。因此,她开始确定这种压力是否是细胞失去活动能力的原因。事实上,用不同的错误折叠蛋白诱导内质网应激也会损害细胞迁移。
当Guo在这些细胞中过表达 ZIP7 时,积压的错误折叠蛋白消失了,内质网应激消失了,细胞恢复了活动能力。“我感到非常惊讶,我不得不质疑自己是否做对了所有事情,”郭说。“如果这是真的,那么仅ZIP7在解决ER压力方面必须非常有效。
更重要的是,她使用的错误折叠蛋白质,称为视紫红质,其结构中不含锌。这导致郭怀疑ZIP7一定与降解途径的某个地方有关。共同主要作者和博士生Morgan Mutch使用一种药物来阻止蛋白酶体降解错误折叠的视紫红质,并观察到这否定了ZIP7的有益作用。她得出结论,ZIP7必须在蛋白酶体咀嚼错误折叠的蛋白质之前的某个地方起作用。
作者创造了四个修饰的 ZIP7 基因:两个突变破坏了蛋白质携带锌的能力,而另外两个突变则保持不变。他们发现锌运输对于减少内质网应力至关重要。
在这一点上,一个新角色进入了我们的故事:酶Rpn11,它构成了蛋白酶体的一部分。就像试图将一大头西兰花塞进处理场一样,带有泛素标签的错误折叠蛋白质不适合蛋白酶体。Rpn11 剪掉这些标签,使错误折叠的蛋白质能够滑入蛋白酶体核心进行分解。锌是 Rpn11 催化泛素去除所必需的。
.inline-img img {
width: 100% !important;
height: auto;
max-width: 100%;
}
}
“当我看到增加ZIP7表达几乎完全阻止了那些泛素标记蛋白的积累时,我感到非常惊讶,然后很兴奋,”Mutch说。“我们期待相反的结果。”
Mutch 确定 ZIP7 在向 Rpn11 提供锌方面至关重要,使其能够修剪标记有缺陷蛋白质的标签,使它们适合实际分解它们的结构。阻断Rpn11酶证实了这一假设。
“当你发现新的东西时,那种感觉,以前没有人发现过的东西,是科学家最好的感觉,”穆奇补充道。
一种潜在的疗法
结果表明,过表达 ZIP7 可以构成治疗多种疾病的基础。例如,错误折叠的视紫红质会导致视网膜色素变性,这是一种目前无法治愈的先天性致盲性疾病。科学家们已经有一种果蝇的突变导致了类似的疾病,因此研究小组在这些果蝇中过度表达了 ZIP7 基因,看看会发生什么。
“我们发现它可以防止视网膜变性和失明,”蒙特尔说。每只具有突变视紫红质的果蝇通常都会发展为视网膜色素变性,但整整 65% 的 ZIP7 过度活跃的果蝇形成了对光有正常反应的眼睛。
Montell的实验室现在正在与加州大学圣塔芭芭拉分校的Dennis Clegg教授合作,进一步研究ZIP7在人类视网膜类器官中的作用,这些类器官携带导致视网膜色素变性的突变的组织培养物。该项目最初由国家普通医学科学研究所资助。在接下来的三年里,它将得到抗盲基金会的90万美元赠款的支持,因此Montell,Clegg和他们的同事可以测试ZIP7基因疗法将预防视网膜色素变性患者失明的假设。
更重要的是,随着年龄的增长,蛋白酶体的能力会下降,导致许多典型的衰老迹象,并增加与年龄相关的退行性疾病的可能性。靶向 ZIP7 的疗法也可能减缓这些疾病的发展或进展。他们已经取得了可喜的成果,延长了果蝇的寿命。
“这是基础的、好奇心驱动的研究的典型代表,”蒙特尔说。“你只是在研究一些东西,因为它很酷,你遵循数据,最终发现一些你从未打算研究的东西,甚至可能治愈多种疾病。
新闻旨在传播有益信息,英文版原文来自https://news.ucsb.edu/2024/021452/researchers-reveal-new-approach-treating-degenerative-diseases